|
1887 yılında Svante
Arrhenius, sulu çözeltilerine hidrojen
iyonu (H+) verebilen maddelere asit,
hidroksit iyonu (OH-) verebilen
maddelere baz denir, tanımını yapmıştır.
|
 |
Asitler,
su ile karıştırıldığında çözeltiye hidrojen iyonu
bırakan bileşiklerdir. Bütün asitler
hidrojen iyonu (H+) içerir. Genellikle
asitlerin temel özellikleri sıralayalım.
-
Ekşimsi bir tada sahiptirler.
-
İndikatörlerin (belirteçle) rengini
değiştirirler.
-
Bazlarla kimyasal tepkimeye girerek ruz ve
su oluştururlar.
-
Asitler mavi turnusol kağıdını ve sarı
renkli metil oranjı kırmızıya çevirirler.
-
Aktif metallerle tepkimeye girerek hidrojen
gazı oluştururlar. |
Asitler
kuvvetli veya zayıf olması PH değerine (Sulu çözeltideki Hidrojen iyon
miktarı) bağlıdır. PH değeri 7'ye
yakın olanlar zayıf asidik, PH değeri 0'a yakın olanlar zayıf bazdır.
Örneğin sirke içindeki asedik asit (CH3COOH) zayıf asit iken,
midemizdeki hidroklorik asit (HCl) kuvvetli asittir.
|
|
|
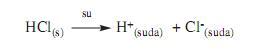 |
Bakır (Cu) , civa (Hg) ve gümüş (Ag) gibi
yarı soy metallere yapısında oksijen
bulunmayan HCl, HBr gibi asitler etki etmez.
Bu metallere HNO3 ve H2SO4 gibi kuvvetli
asitler etki eder. Ancak bu tepkimelerde
asitler asit olarak değil yükseltgen olarak
etki eder. Yani bu tepkimelerde H2 gazı
değil H2O oluşur. Au ve Pt gibi soy
metallere asitlerin hiçbiri yalnız başına
etki edemez. |
|
|
|
 |
Bazlar, su ile
karıştırıldığında çözeltiye hidroksit iyonu
(OH-) bırakan maddelerdir. Örnek olarak
Sodyum hidroksit (NaOH), Amonyum hidroksit
verilebilir.
Genelliklerin bazların temel özelliklerini
sıralayalım.
-
Acı tada sahiptirler. Biberin, kireç kaymağı
ve sabun köpüğünün tatlarının acı olmasının
sebebi bazik olmalarındandır.
-
El ile dokunulduğunda kayganlık hissi verirler.
Sabun, sodyum bikarbonat ve kostik sodaya el
ile dokunulduğunda kayganlık hissedilir.
-
İndikatörlerin (belirteçlerin) rengini
değiştirirler. Kırmızı turnusol kağıdını
maviye, renksiz fenolftalein çözeltisini
pembeye çevirirler.
|
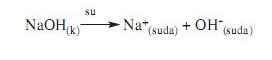 |
Bazlar kuvvetli veya
zayıf olma durumları PH veya POH değerine bağlıdır.
PH değeri yediye yakın olanlar zayıf bazik,
PH değeri sıfıra yakın olanlar zayıf bazdır.
Örneğin amonyum
hidroksit, zayıf bir bazdır ve çözeltiye az
miktarda hidroksit iyonu (OH) bırakırlar. |
|
|
 |
Tuzlar
- Tuzlar iyon yapılı bileşiklerdir.
- Suda iyonlaşarak çözündükleri için
çözeltileri elektrik akımını iletir.
- Katı halde elektrik akımını
iletmezler. Ancak ısı etkisi ile eritilmiş
halleri ile sulu çözeltileri elektrik
akımını iletir. |
|
Hidayet TERECİ |